範圍: 南一版選修化學第二冊1-1~1-5
本篇所有圖片素材皆為自行繪製&渲染 / 內容來自講義&學校老師
1-1 氫原子光譜
1. 能量大小比較
(能量大,波長短) γ射線>x射線>紫外線>(380nm) 可見光 (780nm)>紅外線>微波>無線電波 (能量小,波長長)
2. 光的波動性 – 公式
c=\lambda \times v\\
即:\ 光速=波長\times頻率\\
\ \\
單位:c\ (光速)=3\times10^8m/s,\ \lambda\ (波長):m,\ v\ (頻率):s^{-1}\ 或\ Hz3. 光的粒子性 – 公式
E=h\times v=h\times \frac{c}{\lambda}\\
即:\ 光子能量 = 普朗克常數\times 頻率=普朗克常數\times\frac{光速}{波長}\\
\ \\
E: 光子能量,\ h:6.626\times 10^{-34}J\cdot s-> 從上面公式可以推出以下結論:
E\propto v \propto \frac{1}{\lambda}:光能與頻率成正比,與波長成反比4. 氫原子能階: 如圖所示

5. 芮得柏方程式 (鵬與楊說不用背)
\frac{1}{\lambda}=R\times (\frac{1}{n_f^2}-\frac{1}{n_i^2})\\
\ \\
(R=芮得柏常數=1.097\times 10^{-2}\ nm^{-1})6. 光譜線
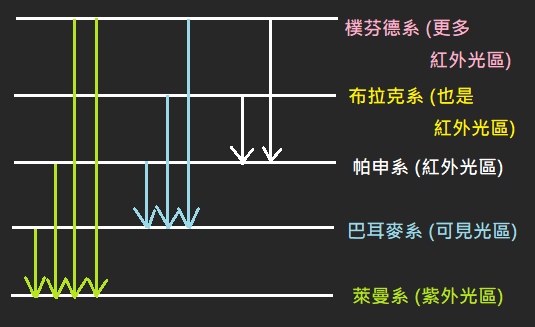
7. 酷酷的規則:
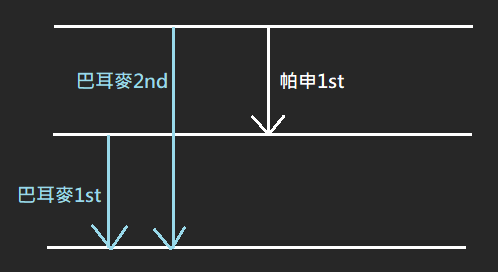
E_{巴耳麥_{2nd}}=E_{巴耳麥_{1st}}+E_{帕申{1st}}\\
\ \\
v_{巴耳麥_{2nd}}=v_{巴耳麥_{1st}}+v_{帕申_{1st}}\\
\ \\
\frac{1}{\lambda}_{巴耳麥_{2nd}}=\frac{1}{\lambda}_{巴耳麥_{1st}}+\frac{1}{\lambda}_{帕申_{1st}}1-2 波爾氫原子模型與能階
1. 拉塞福原子模型
1) 帶負電的電子繞著原子核運轉,如同太陽系中的行星圍繞太陽。
2) 有以下問題:
- 「原子的悲劇」: 電子在原子核附近繞行運動,放出電磁波失去能量後最終會落在原子核上,造成原子毀滅。 -> 不合理,現實情況原子不會毀滅
- 電子在下墜過程中,輻射能量應該是連續光譜 -> 現實中的氫原子光譜為不連續光譜
2. 波爾氫原子模型
1) 電子以特定軌道圍繞原子核運轉,電子不必放出能量來維持狀態。
2) 軌道具有特定能量,由低到高排列稱為能階。
3) 氫原子電子從最低能階n=1(基態)吸收特定能量到高能階,稱為激發態;反之會放出光或熱。
3. 能量、頻率與波長的關係公式:
\Delta E=E_{光子}=hv=2.179\times 10^{-18}\times |\frac{1}{n_f^2}-\frac1{n_i^2}|\\
\ \\
|\Delta E|=|E_f-E_i|=k\times (\frac{1}{n_f^2}-\frac{1}{n_i^2})\\
\ \\
v=\frac{2.179\times 10^{-18}}{h}\times |(\frac{1}{{n_f}^2}-\frac{1}{{n_{i}}^2})|\\
\ \\
\lambda = \frac{91.2}{\frac{1}{{n_f}^2}-\frac{1}{{n_i}^2}}1-3 原子軌域
1. 量子力學原子模型
- 以軌域概念替代軌道: 原子並非以繞圓周方式運動,而是以機率大小分布區域作為電子出現的空間
- 軌域: 電子出現機率90%以上的區域
2. 軌域與量子數
- 主量子數(n): n為任意正整數,其中 n=1 為K層,n=2 為L層,n=3 為M層,n=4 為N層…以此類推。n越大,軌域的範圍越大。
- 角量子數(𝓁): 範圍為 0 ~ (n-1)。其中0為s軌域,1為p,2為d,3為f,4為g…以此類推。此數決定軌域的種類和形狀。
- 磁量子數(m𝓁): 範圍為 -𝓁 ~ +𝓁。此數決定軌域的數量和分布方向。
- 自旋量子數(ms): 範圍為 +1/2 ~ -1/2,表示電子自旋方向。
- 整理表格:
| 主量子數 n | 角量子數 𝓁 | 磁量子數 m𝓁 | 軌域中方向 | 自旋量子數 ms | 殼層最多電子數 |
|---|---|---|---|---|---|
| 1 (K) | 0 | 0 | 1s | ±1/2 | 2 |
| 2 (L) | 0 1 | 0 -1, 0, +1 | 2s 2px , 2py , 2pz | ±1/2 | 8 |
| 3 (M) | 0 1 2 | 0 -1, 0, +1 -2, -1, 0, +1, +2 | 3s 3px , 3py , 3pz 3dxy , 3dxz , 3dyz , 3dx2-y2 , 3dz2 | ±1/2 | 18 |
| 4 (N) | 0 1 2 3 | 0 -1, 0, +1 -2, -1, 0, +1, +2 -3, -2, -1, 0, +1, +2, +3 | 4s 4px , 4py , 4pz 4dxy , 4dxz , 4dyz , 4dx2-y2 , 4dz2 4f, 4f, 4f, 4f, 4f, 4f, 4f | ±1/2 | 32 |
| 以此類推 |
3. 軌域圖形
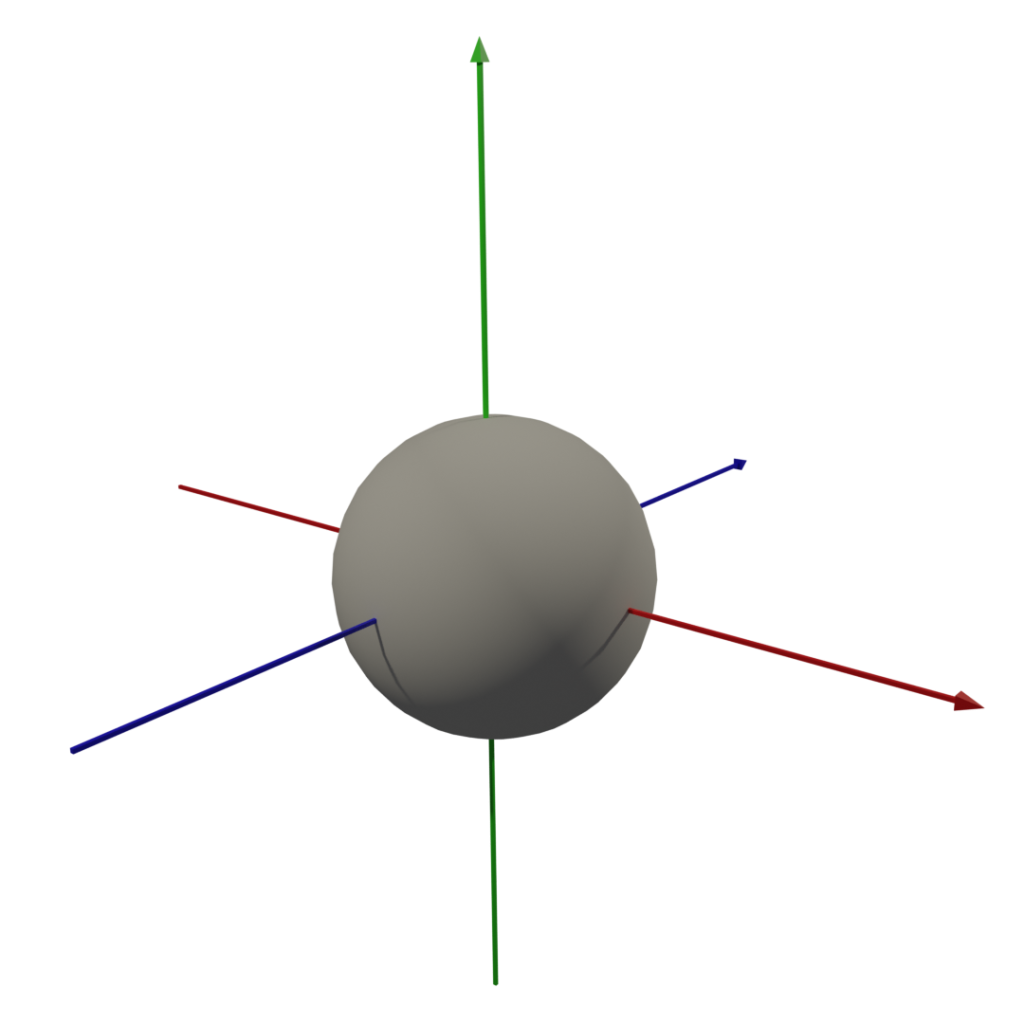
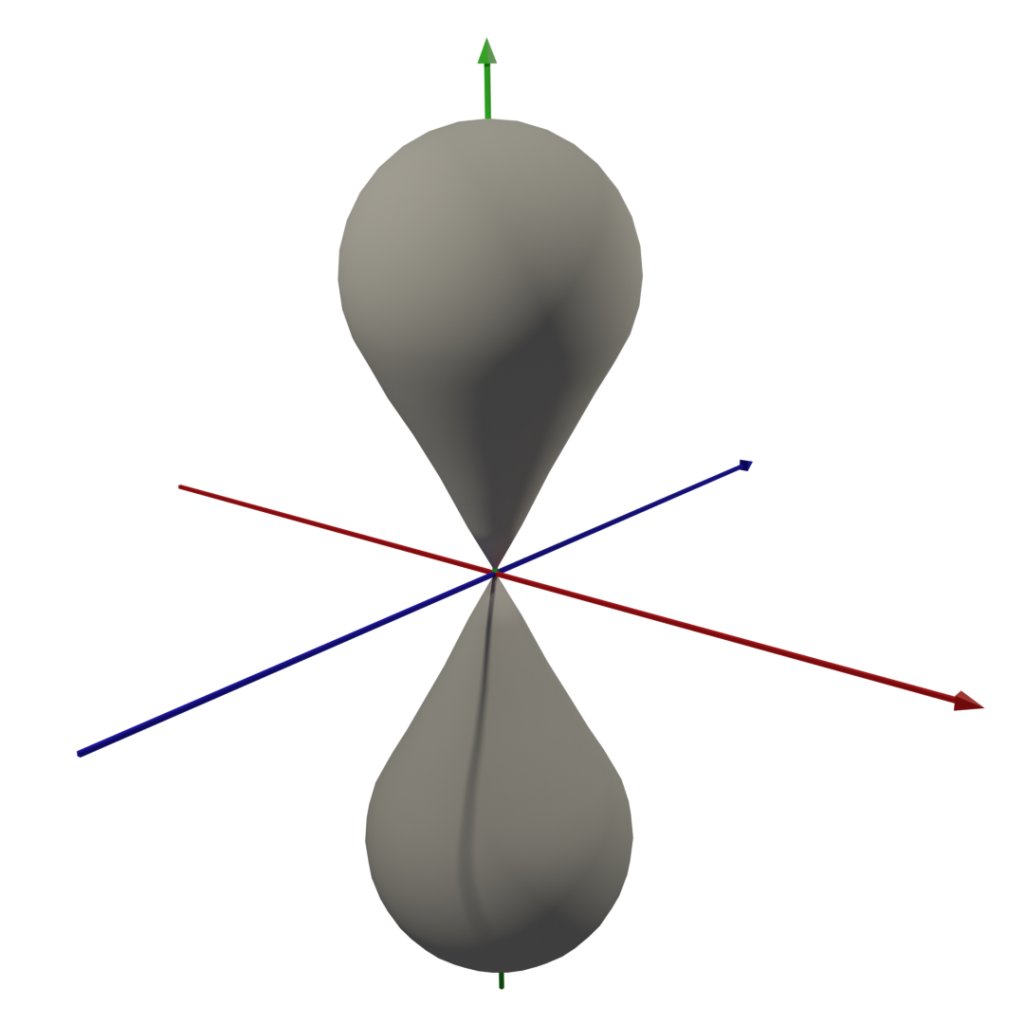
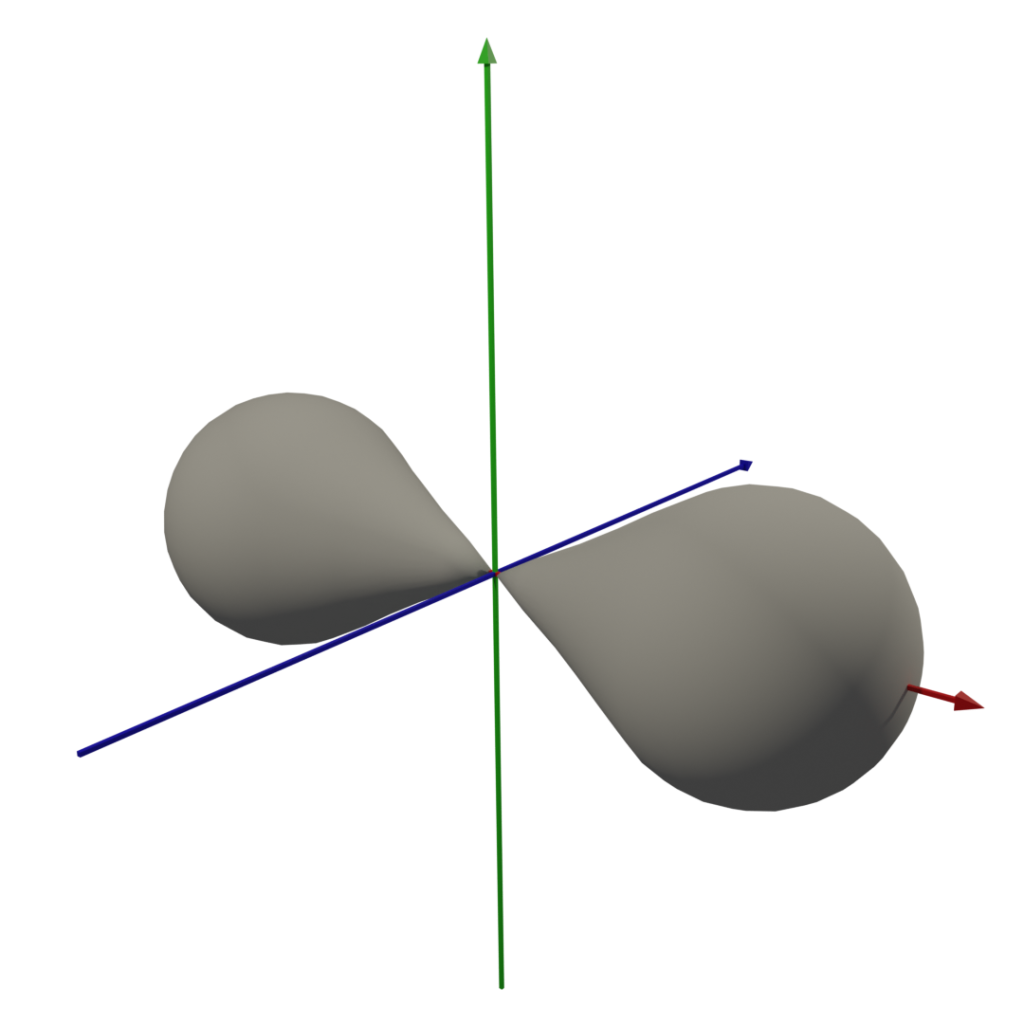
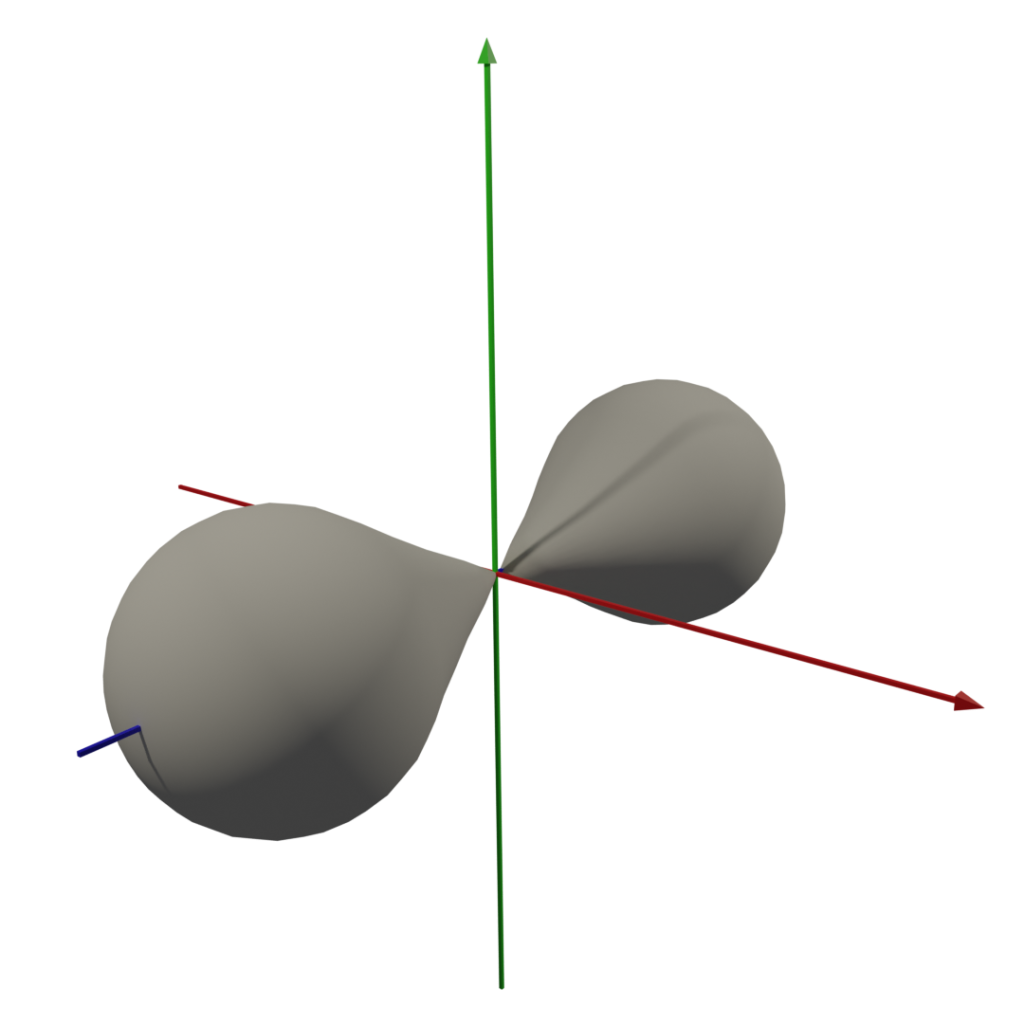
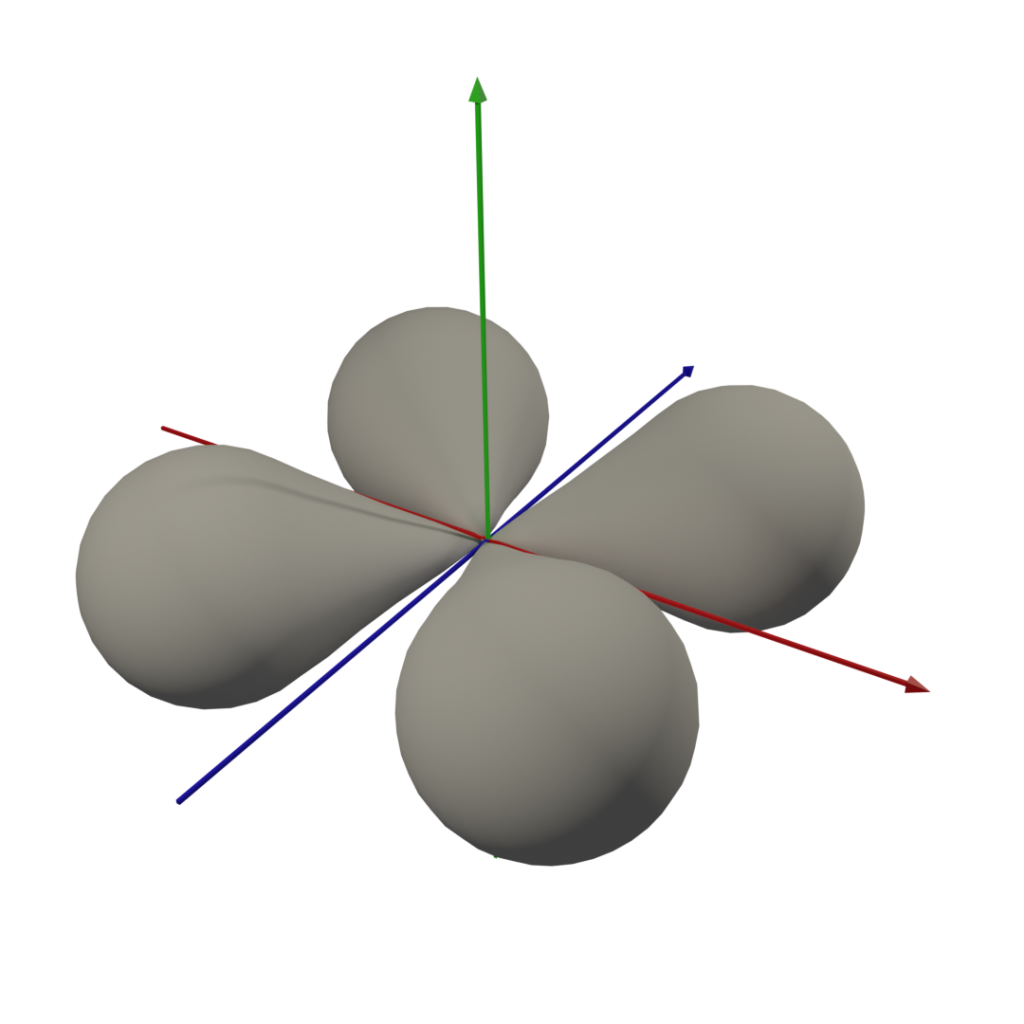
因為我懶,所以dxy後面的軌域形狀請自行google,嘿嘿 (這圖我做了半小時QQ)
4. 氫原子、多電子原子的軌域能階區別
對氫原子及單電子離子(He+ , Li2+ …) 來說,n 越大能階越高,n相同能階相同。如下:
1s<2s=2p<3s=3p=3d<4s...
而對於多電子原子來說,軌域能階由(n+𝓁)決定。如(n+𝓁)相同,則n大者能階較大。我們可以推斷出以下規則: (把這個背起來就無敵了)
np>(n-1)d>(n-2)f>ns\\ \ \\or\\ \ \\ ns<(n-2)f<(n-1)d< np
範例: (要背這個也可以,但很浪費時間)
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<...
1-4 電子組態
1. 定義: 即用來表示原子中的電子分布、排列情形。
2. 電中性、陰離子按照下面方式排列:
- 包立不相容原理: 同一軌域只能容納 自旋方向相反 的兩個電子,如違反此規則該電子將不會存在。
- 遞建原理: 原子中所含有的電子依軌域能量排列(從低至高能階),如違反該電子為激發態。
- 洪德定則: 填入同能階的電子應先將每個軌域填滿一個電子,再開始填入方向相反的電子。
如果是陽離子,則: 不能先直接算電子數,一定要先寫出電中性的元素電子組態,再由n大的先取電子。
3. 電子組態表示法: 按照主量子數(n)大小、同n則照𝓁順序排列,將電子寫在軌域符號右上角。
範例:
\ _1H:1s^1\\ \ _2He: 1s^2\\ \ _3Li: 1s^22s^1\\ ...
非價殼層可以用惰性氣體縮寫(如果有),例如:
\ _{15}P:[_{10}Ne]3s^23p^3\\
\ \\
\ _{33}As:[_{18}Ar]3d^{10}4s^24p^3注意以下特殊情況:
- 鉻: 因為半滿3d軌域(3d5)+4s1能量較4個電子的3d軌域(3d4)+4s2低、較穩定,因此寫法如下:
_{24}Cr:1s^22s^22p^63s^23p^63d^54s^1\\
\ \\
or\\
\ \\
\ _{24}Cr: [\ _{18}Ar]\ 3d^54s^1- 銅: 同鉻,但這次是3d全滿(3d10)。寫法如下:
_{29}Cu:1s^22s^22p^63s^23p^63d^{10}4s^1\\
\ \\
or\\
\ \\
\ _{29}Cu: [\ _{18}Ar]\ 3d^{10}4s^15. 一些神奇規則跟解題技巧:
- 對A族元素或離子來說,如電子數相同,電子組態必相同 (如遇到B族,只能寫出電子組態比較)
- 8A族 He, Ne, Ar, Kr, Xe, Rn, Og 原子序分別為 2, 10, 18, 36, 54, 86, 118
1-5 元素性質的週期性
電子組態規則
1. 主族元素 (典型、A族元素)
- 最後一顆電子填入s(IA, IIA)或p(IIIAA~VIIIA)軌域
- 價電子數=族數(除了He)
2. 過渡元素(B族元素)
- 最後一顆電子填入d軌域;全為金屬元素
- 價軌域為ns與(n-1)d軌域
3. 內過渡元素
- 最後一顆電子填入f軌域 (鑭系:4f,錒系:5f)
原子和離子半徑
1. 金屬原子半徑: 原子核距離一半
2. 非金屬原子半徑: 共價鍵長為半徑
3. 原子半徑大小:
- 同族元素,原子量越大半徑越大 (因為: 越多電子)
- 同週期元素,原子量越小半徑越大 (因為: 質子越多,吸引力越大)
4. 離子半徑大小:
- 同種元素: 陰離子 > 原子 > 陽離子
- 不同種元素: 質子數越大,半徑越小

游離能
1. 定義: 將氣態原子之最外層電子移至無限遠所需的最小能量,為游離能。通常以IE表示。
2. 第n游離能: 由原子最外層電子移出第n顆電子所需之能量。
3. 若 IEn << IEn+1 ,代表該元素有n顆價電子。
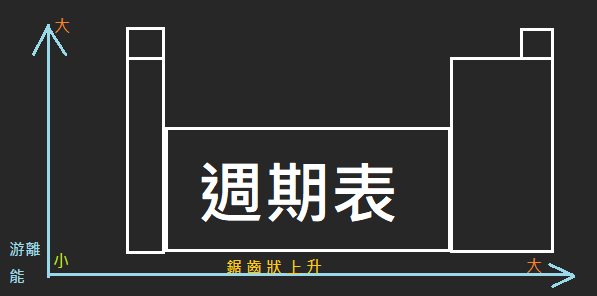
4. 游離能大小:
- 同族元素,原子量越大游離能越小
- 同週期元素,游離能呈鋸齒狀由左至右遞增
IA< IIIA< IIA< IVA< VIA< VA< VIIA < VIIIA
- 等電子數的粒子,質子數越大,游離能越大。
- 同一種元素,陽離子及原子的游離能 必 大於陰離子的游離能。
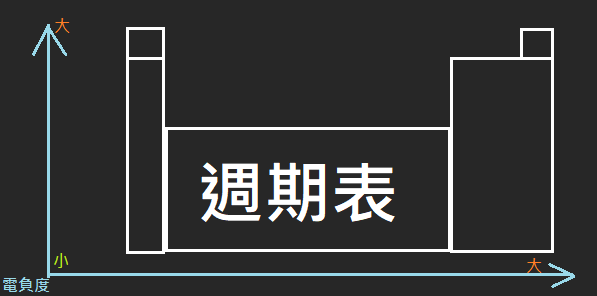
電負度
1. 定義: 原子吸引電子的能力
2. 特徵: 電負度大於2.1的通常為非金屬,反之為金屬。
3. 電負度大小:
- 同族元素,電負度由上到下遞減
- 同週期元素,電負度由左到右遞增
END
有錯誤歡迎留言指正,救救我的段考成績QQ